Un interés dedicado al conocimiento y las tecnologías para la salud a partir de venenos de alacranes
Lourival Domingos Possani Postay
Palabras clave: arácnidos, canales iónicos, antivenenos, péptidos antimicrobianos, noxiustoxina.
El veneno de los alacranes
Los alacranes son artrópodos pertenecientes al grupo de los arácnidos. Son animales muy antiguos que aparecieron en la superficie terrestre hace más de 450 millones de años. Durante este amplio periodo de tiempo, hubo oportunidad para seleccionar muchas sustancias en su veneno, que les ha permitido defenderse de sus depredadores y obtener las presas de las que se alimentan. La biodiversidad de estos arácnidos es enorme: se conocen cerca de 2 mil 700 especies distintas, de las cuales México tiene por lo menos 280, además de las que aún no han sido descritas.
El veneno de alacrán de cualquier especie contiene una mezcla bastante compleja con miles de sustancias con una diversidad de funciones que seguimos descubriendo. Lo que mejor sabemos hoy es que en sus venenos hay gran cantidad de compuestos de tipo proteico, como péptidos (pequeñas proteínas), con efectos tóxicos que interfieren con la comunicación celular, principalmente en células excitables como las células nerviosas y musculares, en cuyas membranas existen otras moléculas de gran tamaño —los canales iónicos— (que describimos más adelante) y que son necesarias para la comunicación sensorial y motora. Sabemos también que hay muchos otros componentes proteicos y no proteicos con función desconocida.
Los canales iónicos son poros moleculares que controlan actividades celulares vitales
Las membranas celulares contienen insertadas algunas proteínas que funcionan como canales iónicos; es decir, forman ‘poros’ a nivel molecular que permiten para cada caso, el paso de iones específicos, principalmente átomos eléctricamente cargados de sodio (Na+), potasio (K+), calcio (Ca2+) y cloro (Cl¯). Sus concentraciones relativas a cada lado de la membrana regulan la polaridad (esto es, el nivel de acumulación de cargas a uno y otro lado de ésta) de las membranas celulares, que es una característica de las células vivas, lo cual se mantiene a través de procesos activos y selectivos de transporte. El movimiento de los iones durante la conducción nerviosa y la excitación muscular (lo que se llama, en términos técnicos, “potenciales de acción”), genera corrientes eléctricas a través de ellos, que podemos medir —en milivolts (mV) — en sistemas experimentales [Fig. 1].
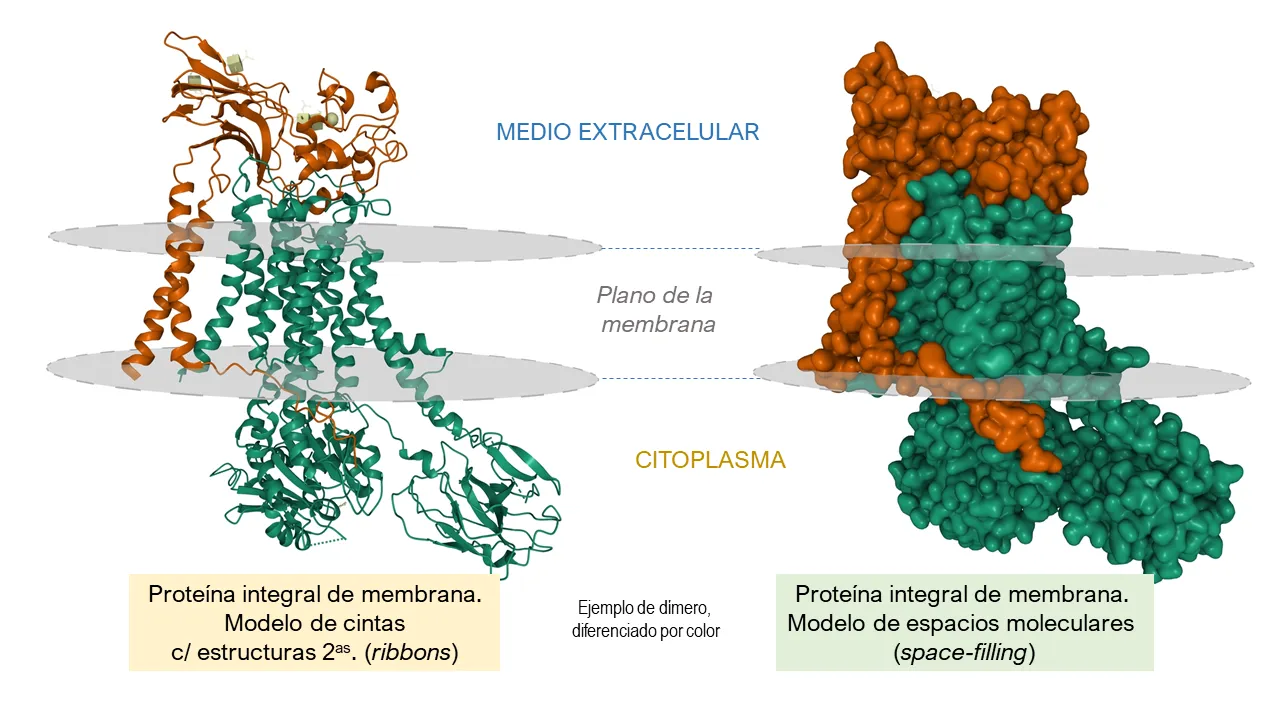
Figura 1.
Esto es importante saberlo, porque los componentes mejor conocidos de los venenos de alacrán son péptidos que reconocen canales iónicos de sodio (afectando principalmente sus mecanismos de apertura y cierre), de potasio (bloqueando los canales) o de calcio (como modificadores y bloqueadores de canales); también existe un péptido llamado ‘intercambiador’, que afecta canales de cloro.
Actualmente sabemos que estos péptidos o pequeñas proteínas —cuyas unidades en secuencia lineal son aminoácidos (aa)— existen en dos grandes grupos: a) péptidos de alrededor de 65 aa que reconocen canales iónicos de sodio, y b) péptidos de cerca de 40 aa que reconocen canales de potasio, calcio y cloro. Los mecanismos moleculares de acción de las toxinas para canales de sodio y potasio son conocidos, para lo cual, recomiendo, para el público especializado, una revisión general de estos hallazgos disponible en varias de las publicaciones científicas de nuestro grupo de investigación [ver ejemplo en la referencia 1].
Existen otros componentes conocidos como son los antibióticos que son péptidos (Hadrurina, Imperatoxina y Vejovina); los péptidos con actividad antiparasitaria (Escorpina), insecticida (Faiodotoxina); y las enzimas (fosfolipasas, hialuronidasas, lisozimas, antareasas y metaloproteinasas), que participan en reacciones bioquímicas de degradación. También se han reconocido péptidos analgésicos, agentes antiepilépticos, péptidos similares a la bradicinina (que, actuando como vasodilatador en el organismo, tiene otros efectos fisiológicos), así como moléculas que degradan grasas (llamados “agentes lipolíticos”) y péptidos que forman poros en las membranas.
Lo que sabemos sobre las toxinas del veneno de alacranes
Antes de mencionar algunos trabajos específicos realizados en México, quiero mostrar cuál es el estado del arte sobre la estructura y función de los venenos. Esto requiere algunos conceptos para entender cómo es que estas toxinas, después de una picadura, causan los efectos en las células y órganos del cuerpo. Partiendo de lo que explicamos sobre las proteínas de membrana (canales iónicos), diremos que están muy relacionados a los cambios de polaridad eléctrica (positiva, negativa, o neutral), a lo largo o en zonas particulares de las membranas de músculos y nervios durante los llamados “potenciales de acción” (que se han definido antes).
En el caso de los canales de iones sodio y potasio, se conocen las secuencias de aminoácidos (esto es, el orden en el que se encuentran constituyendo una proteína) y su forma tridimensional, las cuales son muy parecidas entre ellas. Estos canales proteicos contienen 4 componentes, llamados subunidades o monómeros, los cuales, al asociarse, forman un poro, permitiendo el paso de los iones por su interior y de un lado a otro de la membrana celular. La primera publicación sobre el canal de potasio fue hecha por el grupo del Dr. Roderick MacKinnon, del Instituto Médico Howard Hughes (HHMI - Universidad Rockefeller, EE. UU.), quien ganó el Premio Nobel de Química en 2003 por este trabajo.
Cuando los alacranes pican con su cola en un determinado tejido, las toxinas de su veneno ‘reconocen’ (químicamente) a estos canales iónicos (como una llave a su cerradura) en las células, e interaccionan causando lo que se conoce como una despolarización anómala, ocasionado que presenten los efectos fisiológicos perniciosos asociados a los síntomas de envenenamiento (parálisis, asfixia, entre otros), que pueden llegar a producir la muerte del individuo picado.
Un vistazo al funcionamiento de los canales iónicos
De manera general, en esta sección les mostraré algunos aspectos del funcionamiento de los canales de membranas celulares, para iones de sodio [Na+] y potasio [K+], los cuales son afectados por las toxinas de los alacranes.
Normalmente, los canales son producto de la asociación de dos o más proteínas que atravesando la membrana celular, forman unidades de poro en varios tipos de células, como se puede apreciar en la figura 1.
A través de las membranas se mueven distintas moléculas, en ambos sentidos y por diferentes mecanismos. El que nos interesa aquí es el transporte por canales iónicos regulables, con ‘compuertas’ [Fig. 2, recuadro rojo]. Estos canales experimentan cambios de forma que abren o cierran ‘compuertas’ por donde fluye o se bloquea el paso de iones. Podemos detectar microcorrientes a través de sistemas experimentales de membranas con canales insertados.
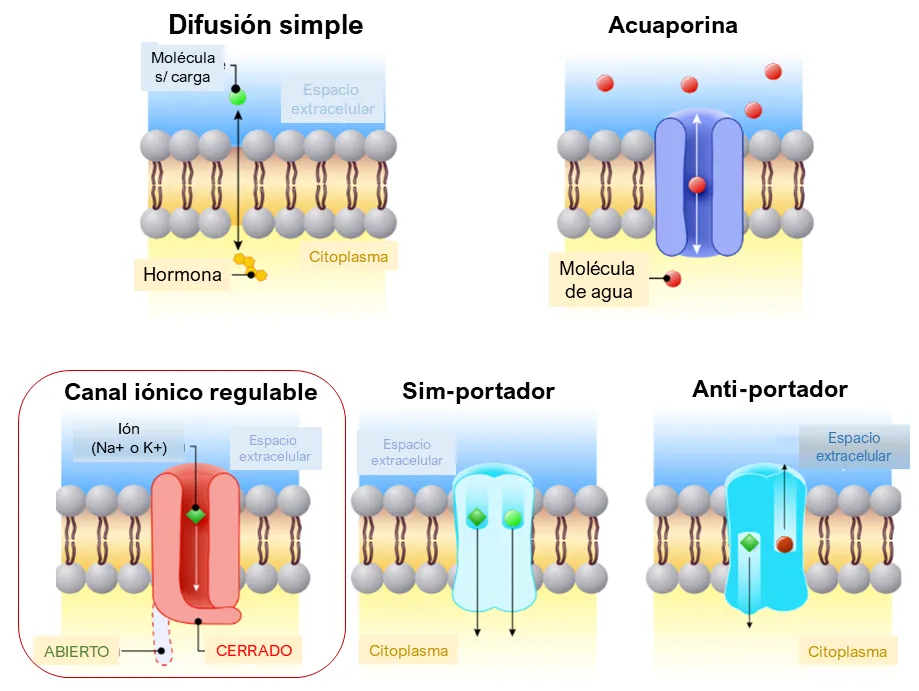
Figura 2.
La polaridad de una membrana (como en las baterías), se refiere al nivel de acumulación de cargas a uno y otro lado de ésta, que se mide en miliVolts (mV); la despolarización ocurre cuando las cargas se mueven de un lado a otro (¡es una corriente que dura milisegundos!) a través y por la superficie de la membrana, por efecto de algún estímulo (p. ej., la propagación de un potencial de acción —o impulso nervioso— o una activación neuronal para contraer un músculo). Se distinguen varios pasos del proceso y cambios en su identidad y duración por efecto de las toxinas [Fig. 3].
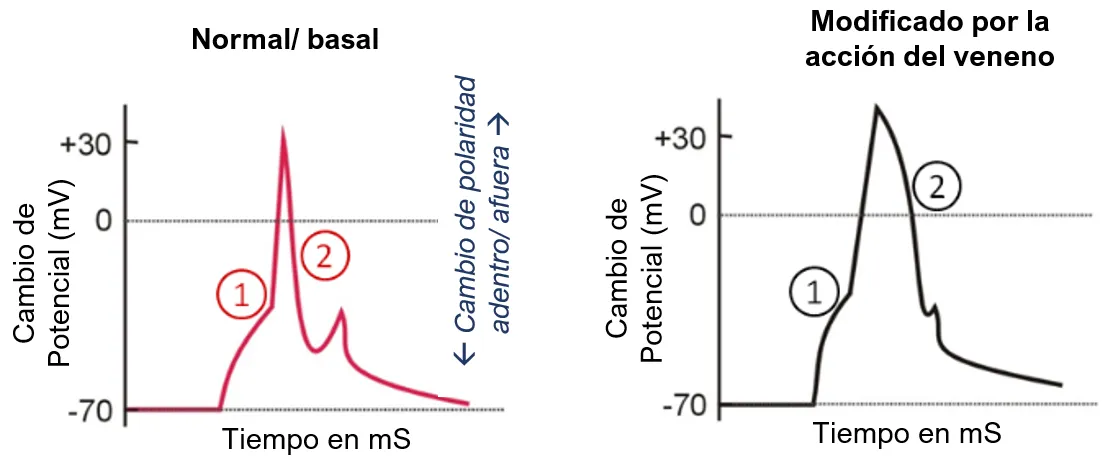
Figura 3.
En estado basal o de equilibrio, y con base en procesos de transporte activo (que consumen energía), hay mayor concentración de iones de sodio en el exterior y más de potasio adentro de la célula; esto puede cambiar drástica y rápidamente por la actividad de los canales (despolarización). En sistemas experimentales, es posible medir los cambios en la polaridad por la adición de sustancias efectoras, y en este caso, por la presencia de los venenos de alacranes [Fig. 4].
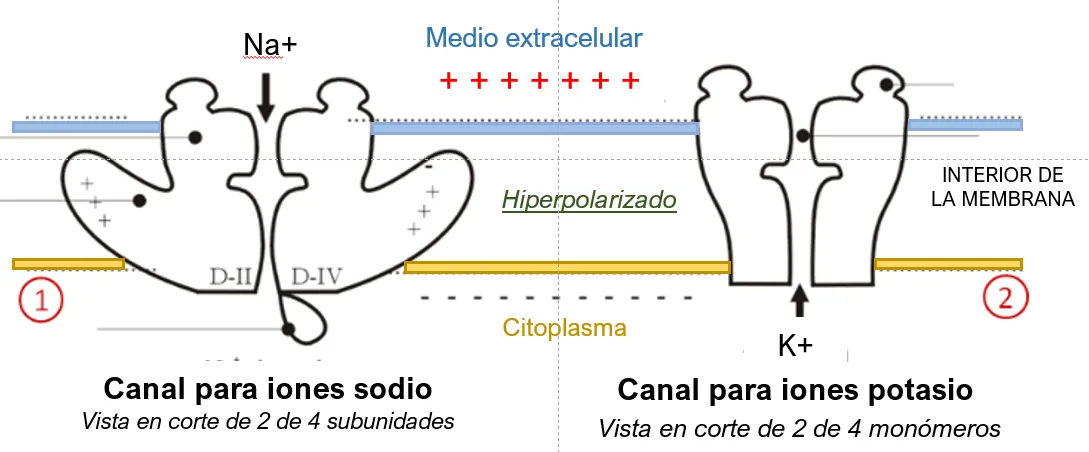
Figura 4.
En la figura 5 se muestra un dibujo esquemático que ilustra el mecanismo molecular de acción de las toxinas del alacrán en los canales para iones de sodio y potasio, capaces de modificar los potenciales de acción de las células excitables. Las toxinas que afectan los canales de sodio son de dos tipos: alfa (α) y beta (β), las cuales interaccionan con la subunidad IV (D-IV) o subunidad II (D-II), respectivamente. Las toxinas llamadas alfa causan un retraso en el cierre del canal, prologando el potencial de acción, mientras que las beta inducen a los canales a abrirse a potenciales más negativos [Fig. 5, Izq.]. En esta misma podemos observar a la toxina tipo (α-KTx) que bloquea la salida de potasio [Fig. 5, Der.].
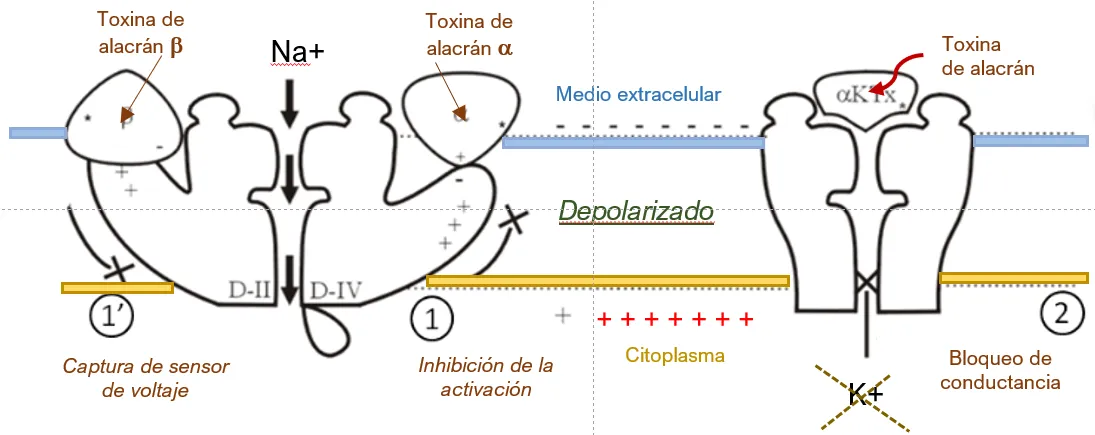
Figura 5.
Varios investigadores hemos estudiado la estructura fina de los canales (sus componentes) y de varios péptidos presentes en los venenos, para saber qué partes de sus moléculas están involucradas en funciones normales o anómalas y, aprovechar ese conocimiento para mejorar antivenenos, diseñar fármacos, entender la evolución de interacciones depredador-presa, entre otros [1, 2, 3, 5].
El trabajo hecho en México
Les comparto los cuatro eventos históricos que resumen el trabajo y experiencia que hemos acumulado, al investigar los componentes del veneno de alacranes en México:
- La colecta de alacranes en su hábitat, la purificación de las toxinas incluyendo la determinación de la estructura y función, así como, un intento para obtener una vacuna sintética en contra del piquete de alacrán [4].
- El aislamiento de los genes (que son los elementos que dan las instrucciones para “codificar” tales proteínas) y su posterior clonación (inserción en una determinado conjunto de genes) para la obtención de toxinas recombinantes (híbridas) a las que se les ha añadido, molecularmente, algunas secuencias de nucleótidos que codifican para proteínas llamadas ‘acarreadoras’ que sirven para tener un mayor efecto inmunogénico (esto es, una mayor capacidad para producir anticuerpos) para la producción de antivenenos, tanto en ratones, como conejos y caballos [6].
- La utilización de equipos y técnicas modernas que han permitido obtener información del total de las proteínas (proteómica) y del material genético (los ARN mensajeros) (transcriptómica) que existen en los componentes del veneno, facilitando la identificación de insecticidas, moduladores de la respuesta inmune, anti-maláricos, antibióticos peptídicos y, en años recientes (2019), de antibióticos no proteicos del tipo de compuestos orgánicos heterocíclicos de bajo peso molecular (ver BiotecMov 18: 20-22 y explicado más adelante), muy eficientes para el control de bacterias como Staphylococcus aureus (causante de infecciones en piel y otras complicaciones graves) y Mycobacterium tuberculosis (agente causal de la tuberculosis) [10].
- Un cuarto grupo de eventos incluye las gestiones para proteger y comercializar algunos productos (ver BiotecMov 31.5 ) y la planificación de proyectos futuros sobre las enzimas (proteínas que tienen capacidad de llevar a cabo reacciones específicas) de los alacranes, los componentes no proteicos y la posible determinación del genoma de un alacrán mexicano [9].
Los reportes principales del grupo
Un par de artículos científicos primigenios sobre las toxinas que estudiábamos fueron publicados, uno en la revista Carlsberg Research Communication [2] y otro en la revista Nature [3], en donde describíamos la estructura y la función de la Noxiustoxina (NTX), un péptido de 39 aminoácidos purificado del veneno del alacrán de Nayarit Centruroides noxius, revelando que es un bloqueador de canales de potasio.
Esta toxina se sintetizó químicamente para caracterizarla mejor y sirvió como primera patente de invención concedida en los EE. UU., en mayo de 1990, al entonces Centro de Investigación sobre Ingeniería Genética y Biotecnología (CEINGEBI) de la UNAM, actualmente Instituto de Biotecnología.
Al mismo tiempo que trabajamos con la NTX nos dedicamos al estudio de las toxinas que afectan el funcionamiento de canales de sodio. Como son el tipo de toxinas que realmente influyen más en los procesos de intoxicación, dedicamos mucho tiempo y esfuerzo para desarrollar una vacuna sintética que protegiera a los humanos en contra del piquete de alacranes.
La toxina 2 de este alacrán nayarita (C. noxius) llamada Cn2 —que es la toxina más potente conocida de un alacrán mexicano y que reconoce con mucha rapidez canales de sodio denominados tipo Nav1.6— contiene 66 aminoácidos, expone cuatro de los llamados enlaces disulfuro |-S—S-| que ‘amarran’ distintas partes de la cadena peptídica. Esta toxina, con 2.5 microgramos por 20 g de peso corporal, causa una letalidad promedio del 50% del grupo de ratones sometidos al ensayo toxicológico (una DL50 o dosis letal media comparativamente baja). Estas fueron algunas de las razones de nuestro interés por purificar y caracterizar esta toxina.
Usando varias técnicas sofisticadas, pero que actualmente son estándar en un laboratorio de Bioquímica, la toxina se purificó y se dilucidaron tanto su secuencia primaria como su estructura tridimensional. Esta última fue determinada en colaboración con la Dra. Muriel Delepierre del Instituto Pasteur en París.
También purificamos y secuenciamos una serie de toxinas similares de otras especies de alacranes mexicanos [mencionados en la Ref. 1], e implementamos la síntesis química de segmentos de estas toxinas para su uso como posibles inmunógenos capaces de generar anticuerpos protectores (esto es, anticuerpos que neutralizan a la toxina en cuestión) en animales experimentales.
¿Vacunas o antivenenos contra alacranes?
Con la intención de reducir los efectos de alacranismo en México sabíamos que este conocimiento era importante, y queríamos desarrollar una vacuna en contra del veneno de los alacranes mexicanos. Sintetizamos entonces cientos de péptidos con secuencias parciales de las toxinas y en experimentos cuidadosos, estos péptidos fueron ensayados en ratones.
Estos péptidos, que funcionan aquí como “antígenos”, sí generan anticuerpos que reconocen a la toxina. Sin embargo, desafortunadamente, la afinidad (esto es, la capacidad y fuerza con la que un antígeno se une a su anticuerpo) de este grupo de anticuerpos, derivados de la inmunización, no fue capaz de proteger in vivo a los animales previamente inmunizados con dichos péptidos sintéticos. Consecuentemente, esto nos llevó a publicar en la revista Vaccine, un artículo donde concluimos que esta estrategia no era la más adecuada para atacar el problema del envenenamiento por picadura de alacranes [4], que es un evento muy agudo que sucede muy rápidamente.
A partir de esta experiencia, diseñamos otra estrategia y entablamos una larga y duradera colaboración con el laboratorio del Dr. Francisco Bolívar Zapata [5] para ahondar en el conocimiento de los genes y avanzar en la síntesis de la toxina Cn2 completa y activa, para probar las aplicaciones terapéuticas de la ingeniería genética. El gen sintético de Cn2 fue introducido en bacterias Escherichia coli (que abundan en nuestro intestino y que son un modelo de trabajo muy usado en la biología molecular) y crecidas para producir una toxina modificada para inmunizar.
Por otro lado, se habían incorporado mutaciones específicas a este ADN (que se traducen en cambios de ciertos aminoácidos de la Cn2), para identificar los segmentos activos de la toxina. Finalmente, los fragmentos de ADN de alacranes que codifican para la toxina Cn2, y para otras toxinas similares aisladas de Centruroides limpidus (alacrán de Guerrero y Morelos) y Centruroides suffusus (alacrán de Durango), se modificaron para producir moléculas híbridas, que iban fusionadas a una proteína ‘acarreadora’ llamada thioredoxina.
Estas proteínas híbridas son menos tóxicas, pero son excelentes inmunógenos para la producción de anticuerpos protectores en ratones, conejos y caballos. Además, han sido capaces de proteger en los modelos de ensayo, en contra de todos los venenos de alacranes peligrosos aplicados, como se describió en un reporte que publicamos en la revista Toxicon [6].
Con todo, esta estrategia se patentó y la UNAM licenció los derechos de la patente a Laboratorios Silanes S.A. de C.V., y su subsidiaria Instituto Bioclon S.A. de C.V., para la producción de antivenenos. Esto sustituiría al uso de macerados de las glándulas venenosas de alacrán que usualmente se inyectan en caballos con el fin de generar el complejo coctel de anticuerpos que típicamente se encuentran en las preparaciones de antivenenos que usan tal técnica de inmunización.
Antivenenos de nueva generación
Asimismo, la toxina Cn2 fue utilizada para la producción de anticuerpos monoclonales (generados como poblaciones únicas e inmunológicamente muy específicos), que a su vez sirvieron para diseñar una estrategia de producción para un nuevo tipo de antiveneno anti-alacránico. Una de las poblaciones de anticuerpos obtenidos (con código BCF2), mostró ser neutralizante, no sólo de la toxina nativa Cn2, sino también en contra del veneno total de Centruroides noxius. Más aún, un fragmento ‘recortado’ (denominado “F·a·b”) del anticuerpo monoclonal BCF2, también era neutralizante [7].
Esto fue el punto de partida para que el grupo de nuestro colaborador, el Dr. Baltazar Becerril y de su estudiante, actualmente la investigadora Dra. Lidia Riaño, se dedicaran a optimizar la producción y capacidades neutralizantes de los anticuerpos monoclonales. Esto implicaba encontrar aquellos fragmentos del anticuerpo BCF2 que conservaran las funciones de los sitios de acoplamiento con la toxina (que se localizan en los conocidos como ‘dominios variables’ de los anticuerpos/ inmunoglobulinas; (ver art. 32. 3 en este número).
Esta población podría seleccionarse usando una técnica sofisticada llamada ‘despliegue en fagos’. Al final, se obtienen secuencias de ADN recombinante para producir proteínas que actúan como ‘anticuerpos de cadena única’ (abreviado ScFv, en la literatura científica), que son capaces de neutralizar a la o las toxinas principales de todos los alacranes peligrosos a los humanos del país. Empleando técnicas genéticas, pero ahora usando ADN humano, se generó una colección (o “banco”) del cual pudieran obtenerse segmentos de anticuerpos humanos de cadena única que protejan en contra de los principales venenos de alacranes de México y de los Estados Unidos. Se registraron varias patentes al respecto y se espera que alguna compañía farmacéutica pueda usar este producto recombinante para substituir el antiveneno obtenido actualmente de caballos, por antivenenos de origen humano [8], ahora producidos en fermentadores. Esta información se describe con más detalle en el artículo del Drs. Baltazar y Riaño en este número BiotecMov 32.3 ).
El uso de nuevas tecnologías
En una tercera etapa de nuestro trabajo, avanzamos hacia el uso de los métodos de secuenciación masiva (ver artículo de R. Grande en BiotecMov 13: 12-21 ) para la caracterización de transcritos de genes (los fragmentos de ARN que son ‘leídos’ por complejos moleculares de las células para sintetizar una proteína), que codifican para todas las proteínas en las glándulas productoras de veneno de los alacranes; es decir, las que se obtienen a partir del ARN aislado de las células productoras de veneno y que —utilizando aplicaciones de la bioinformática para el procesamiento y análisis computacional de secuencias— permite dilucidar las secuencias nucleotídicas que codifican para la síntesis de todas las proteínas del veneno. Esto nos proporcionó información bajo el enfoque de la transcriptómica, que junto con otros complementarios podría ser llamado el venoma, con todos aquellos componentes genéticos, proteicos y metabólicos involucrados en la producción de los venenos por los alacranes.
A esto sumamos estudios por otras técnicas de separación e identificación como la Espectrometría de Masas, que permite reconocer las proteínas del veneno como estrategia de la investigación en proteómica. Esta aproximación técnica permitió obtener miles de nuevas secuencias de las proteínas presentes en los diversos venenos de los alacranes. En los últimos años, varios estudiantes de doctorado trabajaron, publicaron y se graduaron con este tema [9].
En este respecto, debo mencionar que el trabajo de identificación de nuevos componentes de los venenos de alacranes se continuó con el descubrimiento de la existencia de muchos péptidos con funciones antibióticas e insecticida, tales como: Hadrurina, Vejovina, Faiotoxina, Imperatoxina y Escorpina, que se describen más adelante.
Nuevas sorpresas: componentes que no son proteicos
Desde los primeros trabajos de separación de los venenos con técnicas cromatográficas, encontramos que usando ‘filtración molecular’ —que separa por tamaños— se podía identificar una fracción de moléculas de bajo peso molecular, que contenía gran cantidad de substancias de naturaleza no-proteica, esto es, que no eran polímeros de aminoácidos.
Debido al interés médico apremiante por conocer los componentes que causaban la intoxicación de piquetes de alacranes en humanos, esto nos impulsó a analizar los componentes no proteicos de forma inmediata. Por ejemplo, hace poco reportamos la existencia de un alcaloide en el veneno de un alacrán del Estado de Hidalgo (Megacormus gertschi), cuya función todavía es desconocida. Este trabajo se hizo en colaboración con el grupo del Dr. Richard Zare, de la Universidad de Stanford en California, EE.UU. Se determinó la estructura del alcaloide y también se logró la síntesis química del mismo.
Más recientemente, con el mismo grupo del Dr. Zare, identificamos dos compuestos no proteicos en el veneno de un alacrán del Estado de Veracruz de la especie Diplocentrus melici [10]. El veneno de este alacrán, al extraerse es hialino –transparente-; pero en contacto con el oxígeno del aire, adquiere color. Entonces, intentamos identificar si había pigmentos y en cambio, encontramos dos compuestos con estructura química semejante a las benzoquinonas, las que, por la conformación de su molécula, adquieren la capacidad de interactuar con la luz y mostrar color. El veneno como tal, no contiene pigmentos, aunque incluye precursores de los pigmentos; digamos que son las moléculas necesarias para sintetizarlos.
Esto explica que un extracto obtenido con acetona como solvente permitió obtener ahora, dos pigmentos coloridos: uno azul y otro rojo, cuyas estructuras químicas se determinaron [Fig. 6] En una colaboración con la Universidad de Stanford, se sintetizaron ambos pigmentos en el laboratorio y se obtuvieron cristales de ellos. La estructura química se pudo confirmar por difracción de rayos-X, colaborando asimismo con el Instituto de Química de la UNAM.
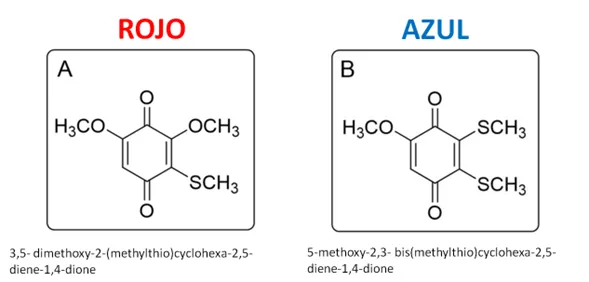
Figura 6.
Este hallazgo nos sugirió hacer ensayos de posibles efectos terapéuticos, ya fuera como antibióticos (para eliminar bacterias patógenas) o como supresor de células neoplásicas (tumorales) en cultivos in vitro, para tratamientos de cáncer por quimioterapia.
En el primer caso, se pudo verificar que los compuestos funcionan como antibióticos que impiden el crecimiento de la bacteria Mycobacterium tuberculosis, causante de la tuberculosis humana. Esto se reportó en una muy importante revista de los EE. UU.: Proceedings of the National Academy of Sciences. [revista conocida como P.N.A.S., 10]. Esto se llevó a cabo gracias a la colaboración con el grupo del Dr. Rogelio Hernández Pando del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ) de la Secretaría de Salud, en la ciudad de México.
Es importante mencionar que se comprobó la eficiencia del antibiótico azul para el control de la tuberculosis, tanto en un sistema de cultivo in vitro, como en experimentos in vivo realizado en ratones, que presentaban un cuadro inducido de esta enfermedad; la aplicación de este antibiótico se hizo por aspersión directamente dirigida a los pulmones. Debido al éxito obtenido con estas substancias obtenidas de precursores aislados del veneno del alacrán D. melici, se redactó y sometió una solicitud de patente (UNAM-Nutrición-Stanford), para proteger el aprovechamiento de este uso de los precursores obtenidos del veneno de alacrán.
En el otro caso, el efecto de dichas benzoquinonas se ensayó en cultivos de células neoplásicas (cancerosas) en tres experimentos: en unas derivadas de un tipo de leucemia (células Jurkat), otras del tipo rabdomasarcoma (E671) y de neuroblastoma de médula (SH-SY5Y); mostrando que las moléculas probadas causaron una letalidad mayor en los tres tipos celulares respecto a los controles; sin embargo, no tuvieron efecto en células de adenocarcinoma de pulmón (A549). Esto último resultó ser muy importante porque permitió ensayar las benzoquinonas en tejido pulmonar infectado con M. tuberculosis, sin generar neumonía. Otras pruebas clínicas, le darán mayor viabilidad como alternativa terapéutica eficaz, segura y accesible contra este tipo de padecimientos.
Referencias
- Possani L., Becerril B et al. (1999). Scorpion toxins specific for Na+-channels. Eur J Biochem 264(2): 287-300. DOI: 10.1046/j.1432-1327.1999.00625.x
- Possani L D et al. (1982). The primary structure of noxiustoxin: A K+ channel blocking peptide, purified from the venom of the scorpion Centruroides noxius Hoffmann. Carlsberg Res Comm 47(5): 285-289. DOI: 10.1007/bf02907789.
- Carbone, E. et al (1982). Selective blockage of voltage-dependent K+ channels by a novel scorpion toxin. Nature 296(5852) : 90-91. DOI: 10.1038/296090a0.
- Calderon-Aranda E S, T Olamendi-Portugal, LD Possani (1995). The use of synthetic peptides can be a misleading approach to generate vaccines against scorpion toxins. Vaccine, 13(13): 1198-1206. DOI: 10.1016/0264-410x(95)00059-a.
- Possani LD, E Merino, M Corona, F Bolivar, B Becerril (2000). Peptides and genes coding for scorpion toxins that affect ion-channels. Biochimie 82(9-10) : 861-868. DOI: 10.1016/s0300-9084(00)01167-6.
- Jimenez-Vargas J M et al. (2017). Design and expression of recombinant toxins from Mexican scorpions of the genus Centruroides for production of antivenoms. Toxicon 128: 5-14. DOI: 10.1016/j.toxicon.2017.01.015.
- Licea A F, Becerril B & LD Possani. (1996). Fab fragments of the monoclonal antibody BCF2 are capable of neutralizing the whole soluble venom from the scorpion Centruroides noxius Hoffmann. Toxicon 34(8): 843-847. DOI: 10.1016/0041-0101(96)00043-8
- Riaño-Umbarila L et al. (2011). Exploiting cross-reactivity to neutralize two different scorpion venoms with One Single Chain Antibody Fragment. J Biol Chem 286(8): 6143-6151. DOI: 10.1074/jbc.M110.189175.
- Cid-Uribe JI et al. (2019). Dissecting toxicity: The venom gland transcriptome and the venom proteome of the highly venomous scorpion Centruroides limpidus (Karsch, 1879). Toxins 11(5) : 247. DOI: 10.3390/toxins11050247
- Carcamo-Noriega, E. N. et al. (2019). 1,4-Benzoquinone antimicrobial agents against Staphylococcus aureus and Mycobacterium tuberculosis derived from scorpion venom. Proc Natl Acad Sci USA 116(26): 12642-12647. DOI: 10.1073/pnas.1812334116.
Comparte este artículo en redes sociales

Acerca de los autores
El Dr. Possani es Investigador Emérito de la UNAM y un reconocido científico a nivel internacional que ha contribuido importantemente al conocimiento, formación de recursos humanos y a la propiedad intelectual sobre animales venenosos, en particular los alacranes.
Contacto: lourival.possani@ibt.unam.mx
Agradecimientos: Estos trabajos fueron apoyados económicamente por la UNAM (principalmente por DGAPA), el CONACyT, el Instituto Médico Howard Hughes, los N.I.H. de los EE.UU., la Fundación Bill y Melinda Gates, y los Laboratorios Silanes S.A. junto a su subsidiaria, el Instituto Bioclon S.A., entre los principales.